超声微泡组合作为靶向药物和基因传递的工具
近20年来,超声作为一种微泡辅助给药工具得到了广泛的研究。最初模型药物被纳入泡泡壳。后来,在动物模型中实现了对失调的肿瘤治疗但这在相当疏水的药物(如紫杉醇)中是可行的。质粒dna可静电附着在气泡壳上,并观察到超声辅助转染的增强作用。载药脂质体附着在微泡表面,使药物具有超声触发的给药能力:在微泡干扰下,药物从脂质体核心释放出来。这已被证明与广泛使用的抗癌药物,如阿霉素和紫杉醇。
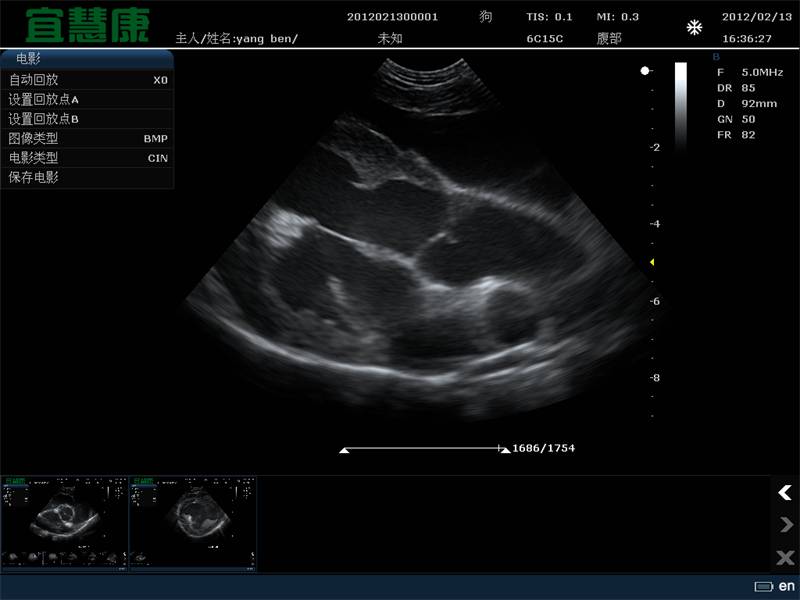
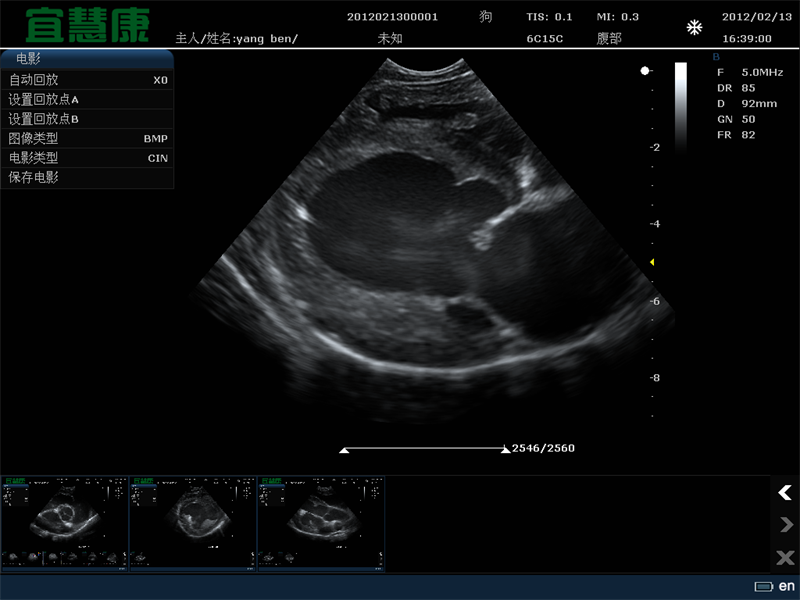
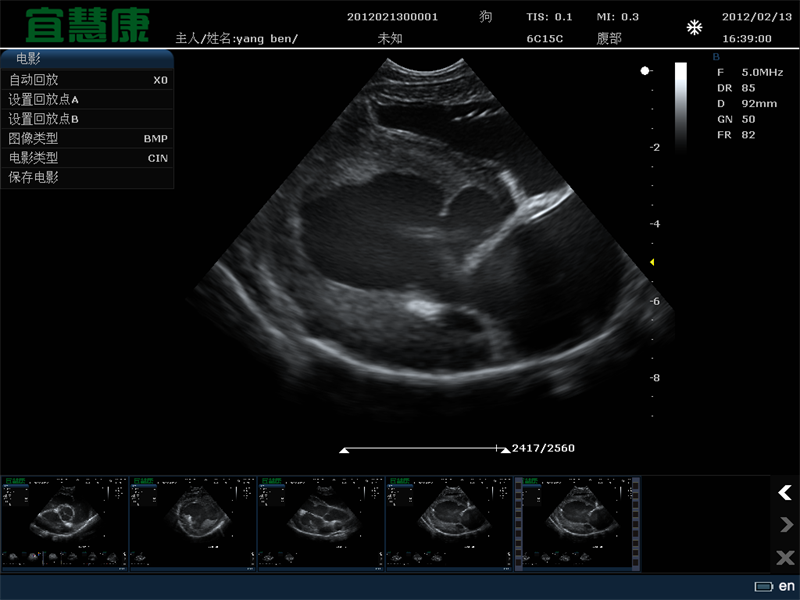
将现有药物与临床分级认可的微泡和聚焦超声联合使用的组合方法显然会更快地进入临床试验。在此方法中,利用血管内微泡的稳定空化来瞬时改变血脑屏障的通透性。屏障的破坏是轻微和短暂的(通透性增强在几个小时内停止)。然而,大的项目,如脂质体和其他纳米粒子可与抗体等较小的项目一样有效地进入脑组织。
其他药物,甚至是基于Gd的MRI造影剂物模型(对相当一部分动物有效)中,通过长期循环的阿霉素脂质体(Doxil)和临床泛氟脲微泡的简单组合,使胶质瘤得到了令人兴奋的演示。治疗的成功可以解释为PEG包被脂质体在血液中停留了许多小时,在不和谐的区域血管和外渗循环了许多小时,只要药物仍然在血液中并且屏障保持开放。从肿瘤治疗到临床应用,可以预测这项技术的发展。
超声诱导大鼠血脑屏障开放的实验研究。先静脉注射去氟丁烷微泡(用DSPC和PEG Stearate稳定),然后立即进行聚焦超声治疗(IGT,1Hz,20 ms脉冲,1~2 min),静脉滴注Gd-DTPA。MRI对比观察超声治疗和Gd-DTPA治疗几分钟后的渗出和积聚(图像中心的白色焦点)。在UVA分子成像中心(7T MRI临床扫描,Bruker/Siemens)进行成像。
类似的治疗方法可以应用于除血脑屏障以外的情况下,也适用于血管中任何阻止药物进入病变组织的内皮衬里。该方法已被应用于将腺相关病毒颗粒传递到不和谐心肌,以及联合使用抗癌药物吉西他滨和Sonovue微泡治疗胰腺癌的原位异种移植小鼠模型。
后一种组合在临床试验中显示了有趣的数据,最初显示了静脉注射吉西他滨对肿瘤生长的抑制作用,然后每隔3.5分钟立即注射Sonovue微泡,并在今后半小时内用超声成像系统连续照射原发肿瘤[179],重复超声/微泡治疗周期,每一次定期使用吉西他滨,可达32周。将这项试验扩大到更大的一组病人,现在表明接受这种治疗的患者的寿命将得到有益的延长,60%的患者能存活12个月。
超声在治疗应用中的生物效应
超声的治疗应用可能超越组织的热或机械破坏或药物输送。超声对组织的作用,可能与微泡结合,可能导致多种治疗生物效应的表现,包括治疗性血管生成[181抑制肿瘤的血流,以治疗性干细胞为靶点,静脉给药后骨折愈合,令人惊讶的是,超声作用于脾神经,减轻急性肾损伤。超声波对大脑的非侵入性刺激也相当有趣。
所有这些技术都是基于超声(作为压力波)在治疗区域提供引导能量沉积的能力;在某些情况下,振动微气泡的存在进一步增强了超声的作用。超声应用所表现出的生理效应是多种多样的,必将导致新的治疗方法和方法的发展。
结语
超声已成为现代医学不可缺少的工具,有助于扩大放射学的范围。结合智能换能器设计、脉冲序列和新的数据处理与分析方案,在不断加快数据处理速率、降低成本、减小电子器件尺寸的基础上,对硬件进行了改进。手持式和膝上型超声波已经被广泛使用,很快就可以取代以手推车为基础的系统.超声造影剂具有监测组织灌注的能力,靶向药物能使分子超声成像血管生成或炎症的生物标志物。将超声引导到身体所需区域的能力为这种方式提供了直接的治疗应用,包括靶向药物和基因传递,以及溶栓治疗的增强。总之,超声作为一种成像和治疗手段正在迅速发展。